时间:2022-08-09 17:22
重组病毒是现代神经科学的主要支柱。人们想了解神经元的形态、自然活动规律、分子结构、神经元连接或生理功能,大多数研究均从重组病毒注射开始,包括腺相关病毒(AAV)或单纯疱疹病毒(HSV)等等。目前通过结合光遗传学、化学遗传学、钙成像等相关方法,重组病毒能够实现细胞特异性、环路选择性、活动依赖性和时空特异性的转基因表达,并常用于研究大脑内某种细胞基因的分子及细胞功能。然而,每种病毒都有优缺点,正确选择病毒工具对于中枢神经系统实验的设计和执行至关重要。
小布在这里给大家分享AR Nectow和EJ Nestler在《Nature Reviews Neuroscience》发表的综述文章“Viral tools for neuroscience”,本文作者讨论了重组病毒的主要原理及用途,并突出了未来所需的创新。

图1 | doi.org/10.1038/s41583-020-00382-z
1 ► 病毒学原理
重组病毒已被广泛用于实验研究,这些载体和它们的功能都有特定的普遍属性。本文作者提出了病毒的六个关键原理:包装及有效载荷、传递方式、嗜性(趋向性)、遗传获取、感染性和毒性以及转基因表达(图2)。这些原理在神经科学家权衡特定病毒的优点和缺点时起着关键作用。
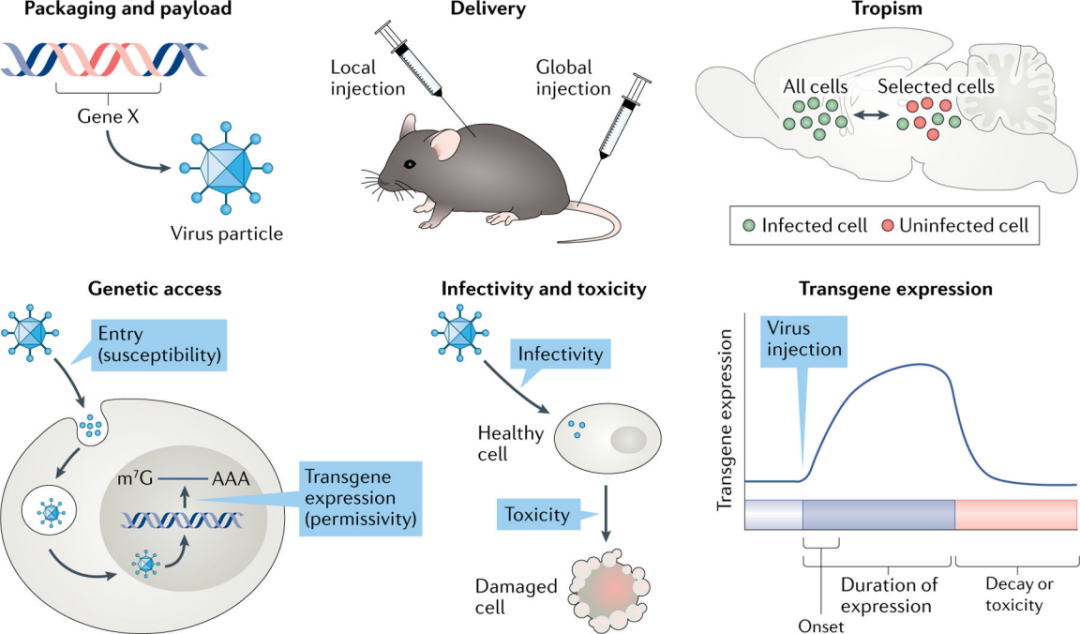
图2 | 神经科学中病毒的关键原理
2 ► 包装和有效载荷
什么能放入病毒,什么不能放入病毒?
重组病毒选择的首要关键考虑是包装和有效载荷。病毒基因组由DNA或RNA组成,这些基因组被包装成特殊病毒颗粒,并被传递到细胞中。病毒基因组的核酸组成也是病毒选择的初始关键决定因素。
每个病毒粒子携带特定大小核酸分子的能力,即 "包装极限",由特定的病毒颗粒决定,其大小由病毒基因组编码。不同家族的病毒颗粒,在基因组核酸包装大小、原始病毒基因组可以移除的程度上都存在很大差异,这些限制决定了新增核酸大小,即有效载荷能力。一些病毒,如AAV或狂犬病毒(RV),其有效载荷能力限制在~3.5-5kb,而甲疱疹病毒(例如HSV和伪狂犬病毒PRV)的有效载荷可能超过数十,甚至理论上数百个千碱基。然而,载荷大小的限制可以通过如分裂蛋白或内含肽类,或使用病毒共传递的方法。
3 ► 递送方式
如何让病毒进入神经系统?
通过在中枢神经系统或外周注射病毒,实现将新基因传递到中枢神经系统。根据实验目的不同,可在中枢神经系统内或外,一个或多个位置注射不同的重组病毒。目前病毒递送方式有“局部”注射和“全局”注射,“局部”注射需要手术,通常是立体定位到中枢神经系统或外周的一个确定的解剖位点;而“全局”注射需要外周注射,通常是通过血液,并依赖转基因鼠或特异性启动子元件来诱导中枢神经系统中特定细胞类型的基因表达。
病毒通过“局部”注射进入中枢神经系统,可能停留在注射位点,也可能广泛扩散。这取决于病毒固有的几个特性,包括病毒顺行或逆行移动的能力,不同细胞间的嗜性和复制能力,以及其他(即电荷)。AAV,犬腺病毒(CAV)和PRV,这三种病毒都通过“局部”注射可达到截然不同的目的。大多数AAV感染神经元的胞体以表达基因产物,而CAV和PRV则优先被神经末梢吸收,并从投射区逆行运输到胞体(图3)。
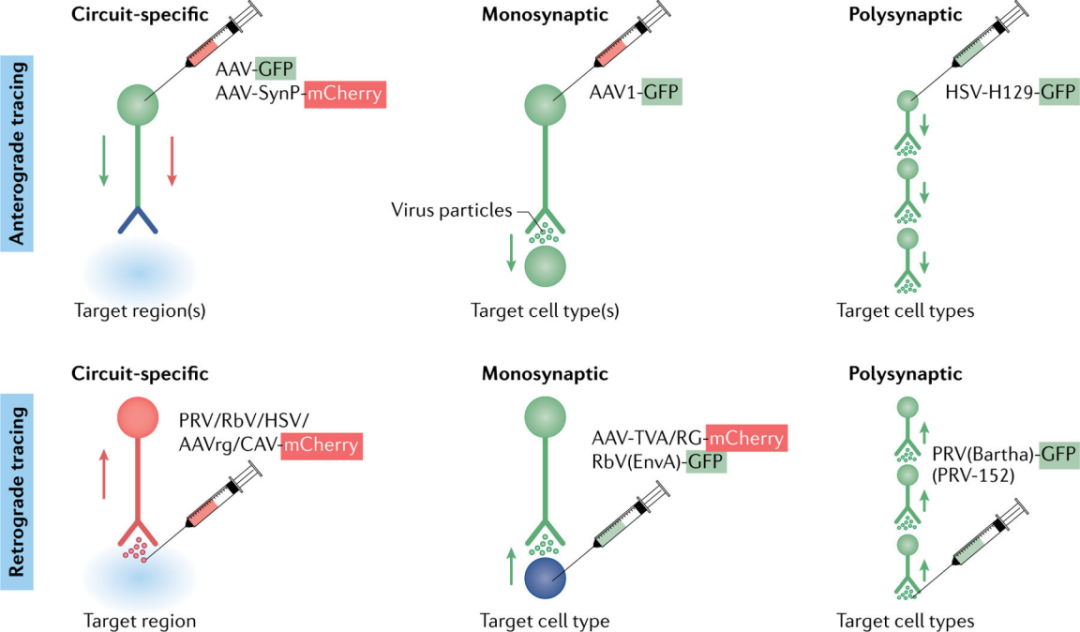
图3 | 神经元示踪的病毒策略
4 ► 嗜性
病毒会去哪里?
病毒嗜性是指病毒颗粒感染特定细胞类型的能力。它决定了体内哪些细胞被病毒感染,以及传递的病毒基因组在特定组织的作用。为了有效地感染细胞,病毒粒子需附着并进入细胞,实现病毒基因组的表达。与非神经元细胞相比,有些病毒能够选择性感染神经元细胞,因此被称为“嗜神经”病毒。与此同时,人们越来越关注产生感染其他细胞类型的病毒颗粒。
进入一个特定的细胞,所有的病毒颗粒必须与其特定的受体结合,这个受体可能是蛋白质、碳水化合物或脂质,由病毒决定。如不同的血清型来自最广泛使用的,它对神经元具有高度的选择性,并且在脑内注射时扩散较小,是神经科学研究的理想选择。其他AAV血清型的扩散性较好,因此适合感染更大的脑区,包括非人类灵长类动物甚至人类的脑区,而还有一些血清型除了感染神经元外还可以感染非神经元细胞。
于病毒衣壳蛋白的差异。为了感染大脑,最常用AAV1、AAV2、AAV5、AAV8和AAV9。AAV2是
5 ► 遗传获得
我们可以利用神经细胞的哪些特性来选择性实现遗传获得?
遗传获得是指病毒进入某种细胞并表达其基因产物的能力。遗传获得依赖于病毒颗粒附着、细胞进入,基因组传递和表达,限制遗传获取的一个例子是比较RV和AAV的使用方法。
RV编码结合受体的膜蛋白G,利用受体结合进入细胞实现遗传获得。RV是一种负单链RNA病毒,不能使用细胞内的“分子逻辑操作”(例如,使用Cre或Flp重组酶激活/抑制转基因表达)。G蛋白缺失的RV(RV-ΔG)已经被设计表达禽ASLV型包膜蛋白(EnvA),EnvA结合鸟类受体TVA,因而不能进入哺乳动物神经元。EnvA伪型RV进入TVA阳性细胞后,则可以表达其转基因产物。
AAV的遗传获得既依赖于细胞的进入,也依赖于分子逻辑操作。首先,不同的AAV血清型与不同的受体结合。第二,一旦AAV基因组进入细胞的细胞核,单链DNA基因组转化为双链DNA。双链DNA的转化过程缓慢,可通过使用自我互补的AAV(scAAV)来避免。scAAV避开了第二链合成,因此表达时间更短。然而,这种方法的缺点是scAAV对转基因的大小限制大约是标准AAV的一半。
6 ► 感染性和毒性
病毒感染细胞的效率和对细胞的危害有多大?
感染性和毒性是密切相关的。所有的细胞都有一个内在的防御系统,它使用“模式识别受体”,与外源蛋白质和核酸结合。与这些受体结合通常会导致一系列的细胞防御反应,如细胞死亡(凋亡)和细胞因子(如干扰素)的表达。病毒感染也会导致细胞生理上更微妙但却意义重大的变化。
理想的病毒载体应该具有高度感染性,毒性最小。然而,这些参数往往特别难以解耦,从而决定了人们在选择最佳病毒时必须做出妥协。许多重组病毒,如AAV、 HSV、CAV和慢病毒(LV)作为“半惰性”载体在神经科学中被使用,它们诱导细胞内在防御的能力降低。相反,多突触环路投射病毒,如RPV、HSV等,需要扩散到最初感染部位以外,而复制通常会激活细胞防御,引起致病效应。由于有效的感染性和毒性很难分离,没有可用的具有最小细胞毒性的多突触示踪剂。
7 ► 表达动力学
你目标转基因在什么时候被表达出来?
病毒粒子将其基因组传递到细胞后,基因表达动力学是实验学者的重要考虑。基因表达的两个关键参数是最大表达的时间(开始)和表达维持的时间(持续)。一些病毒基因组快速表达,然后下降;而其他病毒基因组表达较慢,持续时间较长。不同的基因表达模式适合不同实验目标。在选择病毒时,必须了解这些模式以及每个病毒载体的动力学。例如,如果实验目标是快速和局部表达一个基因产物,可以选择HSV。这种表达特性可以用来研究发育早期基因表达的短暂变化对成年后功能结果的持久影响。然而,如果希望获得局部、长期的细胞遗传获得(纵向研究),则可以选择AAV。
值得注意的是,也可以结合其他转基因方法使不同的病毒搭配使用,通常涉及重组酶(组成型或诱导型)。这种方法可以使短暂的基因表达窗口变长(如,通过表达Cre重组酶来激活一个组成型表达的基因座)和使长窗口变短 {如,使用小分子诱导蛋白,如Cre-ER[一种他莫西芬诱导的Cre或tTA(四环素转导因子)]}。
8 ► 病毒工具的功能和使用
神经元成像及调节神经元活动是更好地理解神经功能的两种关键方法。记录和操纵神经元活动,通常需要长期获取(纵向研究)、一定程度的特异性(细胞类型、投射)及健康细胞(以确保在一定程度上不受脱靶或非生物效应影响)。鉴于这些要求,由于AAV可长期表达、易于生产和使用、细胞毒性小以及可与其他病毒和转基因方法联合使用,已成为神经成像和操作研究中最流行的病毒载体。
为进入特定细胞类型,目前有两种主要的模式:特异性启动子元件和重组酶诱导小鼠。重组酶诱导小鼠(最常见的是cre鼠)是迄今为止最流行、最有效和可复制的方法,与病毒结合使用引入调节或跟踪特定神经元群体活动的蛋白质,包括通道视紫红质(ChR2)、设计药物(DREADD)激活的受体,以及用于纤维光度测定或体内单细胞Ca2+成像的GCaMP和其他指示蛋白。这些方法通过结合重组酶特异性表达和组成启动子(如CAG、EF1α等)实现了高水平表达。
神经元之间的连接为理解神经元的功能提供了重要基础。目前已经开发了许多环路成像工具。这些工具利用了野生型病毒的优势特性——优先感染神经末梢而不是胞体,在细胞内顺行或逆行移动,在突触处或附近向任何方向传播,有时扩散到多个连接的细胞。这些病毒被用于表达一系列转基因,以帮助统一神经元的结构和功能。用于环路绘制的重组病毒目前提供了三大类细胞通路和标记:特定环路,单突触,或多突触。
另一种将结构信息转换成核酸形式的环路绘图方法被称为“条形码”,它使用辛德比斯病毒对神经末梢进行分子标记。将病毒编码的“条形码”正向传递到神经末梢,并解剖和分析假设的目标脑区域的条形码转基因表达。每一个注入的病毒粒子都包含一个独特的条形码序列,这样,通过对目标大脑区域进行测序,就可以推断出神经连接的强度。
在一个目标区域,或是大脑区域,或是特定细胞类型,利用病毒载体操纵感兴趣的基因(过表达或敲除),研究基因对分子、细胞、环路和行为水平影响。这些方法常用于建立正常和病理生理现象中不同类型基因的因果关系(图4)。
病毒介导的基因过表达/敲除可使编码的RNA和蛋白质水平比正常水平高/低一个数量级。基因表达偏向任何一极端都可能产生误导性结论。选择CRISPR工具与病毒载体一起传递到大脑,可在体内可见的表达水平范围内,以调节的方式激活或抑制内源性基因的活性,克服传统病毒载体造成的混淆。
通过对体内感染细胞进行高通量RNA测序(RNA-seq),病毒载体被越来越多地用于描述基因组范围内基因操作的转录组结果。病毒对基因进行操作后,RNA-seq数据集可将受感染细胞的分子特征与细胞形态的改变(例如,树突棘的密度)以及这些细胞在突触和环路水平上的功能改变联系起来(图4)。然而,病毒即使不表达转基因或删除内源性基因,也会诱导细胞的分子组成发生变化。因此,必须进行适当的控制,将遗传损害的影响与病毒本身的影响解耦。
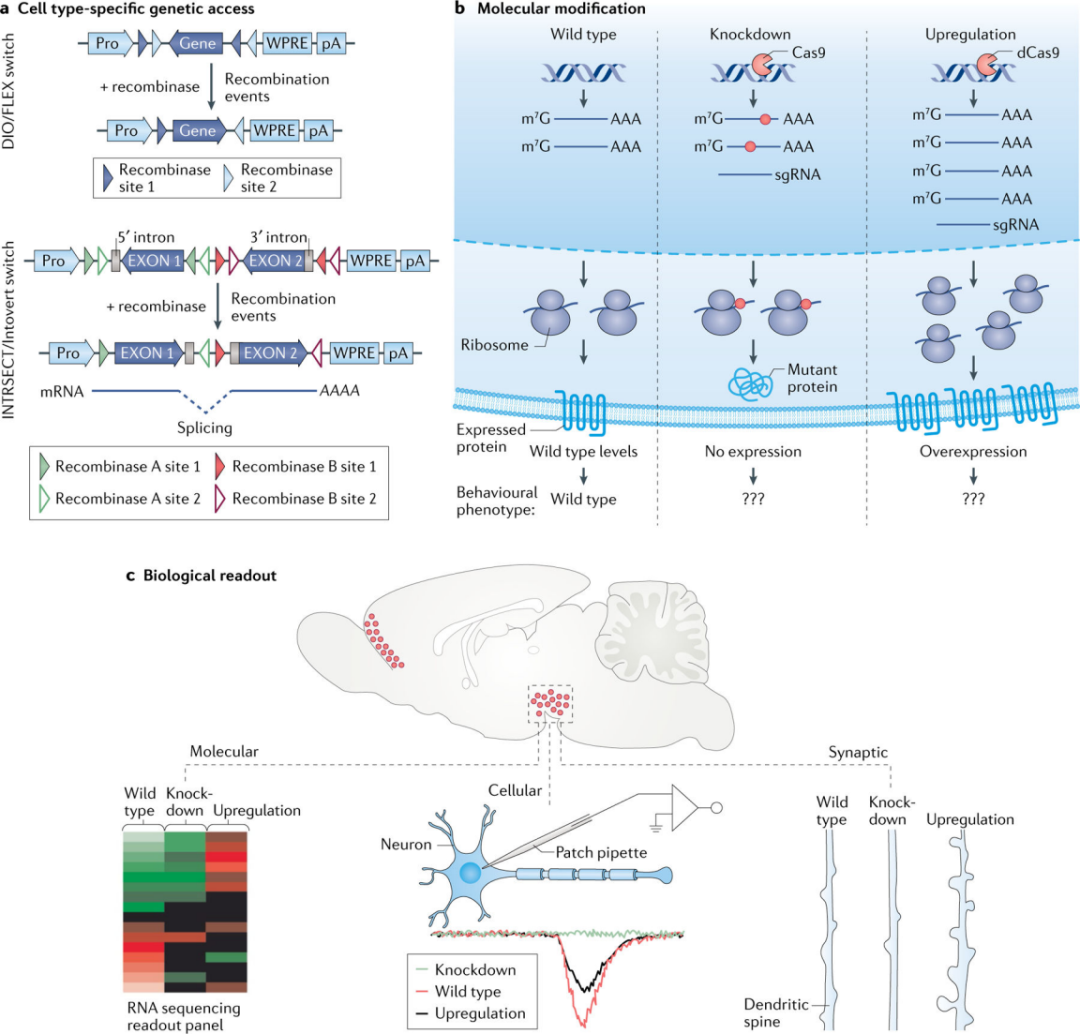
图4 | 研究中枢神经系统中的基因功能
9 ► 未来的方向和结论
病毒工具的出现已成为神经科学家的一大福音,不同重组病毒都有其显著的优势,但也有其局限性。理想的重组病毒具有几个关键特性,包括高滴度、有效载荷不受限制,递送方式简单且伤害最小,能够感染所有细胞类型但只在所需的细胞类型激活,完全无毒(非免疫原性),和可定制及可调节的表达动态。
迄今为止,针对脑疾病的病毒基因治疗的临床试验主要集中在AAV或慢病毒,但仍处于非常早期的发展阶段。除了合理设计和使用病毒外,体内外进化和机器学习等方法,将有望为重组病毒载体工程开辟新的途径。
无论如何,病毒工程的不断进步将提供更多的特异性去定义和进入特定类型细胞。该领域将能够越来越多地利用已知或尚未确定的病毒的关键特性(和局限性)来进一步开发这些功能。
